本笔记基于杨荣武教授第四版《生物化学》(持续更新)
1. 多肽
我们在上一节笔记里面介绍了什么是氨基酸,还有氨基酸的种类以及氨基酸基本的一些性质如等电点极性手性等等,这里我们开始介绍氨基酸结合的产物,因为氨基酸是脱水缩合形成多聚体(这里说聚合体应该更加恰当,因为参与的氨基酸数量不一定足够多),所以其实在肽/蛋白质里面的氨基酸已经不是原来完整的氨基酸,我们称此时经过缩合的氨基酸单位为氨基酸残基。
那么根据氨基酸脱水缩合(这里有必要强调氨基酸脱水缩合第一点不一定是核糖体上进行的第二点即使在核糖体上进行的,也不是简单“相遇”就可以脱水的,每一次脱水缩合需要消耗2个ATP)形成的聚合体的长度(用组成氨基酸数量表示),人为地划分为如果2-10个氨基酸则是寡肽,如果11-50个氨基酸就是多肽,如果50个以上的氨基酸认为是蛋白质。请注意这里的人为操作,其实我认为我们不能用这个氨基酸的数量就限制我们应该如何定义肽和蛋白质的界限。我认为如果多聚体有严格的三维结构,并且这个结构与其功能高度相关,比如有特定的结构域,那么我们就可以把这个聚合体认为是蛋白质,哪怕这个蛋白质的氨基酸数量少于50个(其实我们看到胰岛素,这个人类最先测序的蛋白质的氨基酸数恰好就是51,所以可以认为50就是一个人为限定的因素,自以为没有必要太当一回事,只是一般氨基酸数如果少于50个那么比较大可能是没有办法形成复杂的空间结构的,所以不能说是蛋白质)
然后教材里面有提到目前发现的蛋白质的平均的氨基酸数,那么按照三界来分类细菌、古菌和真核生物的平均蛋白质氨基酸分别是283、311、438,其实课本上也问到为什么呈现出一个递增的趋势,尤其是真核生物显著增多。我想到的是,从细菌到古菌到真核(这里不强调什么进化含义,即使有证据显示真核是古菌进化而来的),从细菌到古菌,因为古菌生活的环境是更为恶劣的,所以蛋白质可能需要更多的氨基酸来维持结构的稳定性,那么到真核生物主要是因为细胞对于生命活动复杂度的要求升高,所以需要结构更复杂,功能更特化的蛋白质来行使功能,所以所需要的氨基酸数量也会增大。
同时教材里面也提到了有些蛋白质的氨基酸数是非常非常巨大的,那么这里小编想到一个问题,首先如果这个蛋白质是不会动态解聚的,那么合成如此巨大的蛋白质其实要冒着极大的风险的,因为组成蛋白质的氨基酸数量越多那么合成蛋白质的过程就有越多出错的可能性,那么一旦其中有合成出错,那么前面合成付出的能量仅仅可以部分收回,其实对于能量来说是一个巨大的浪费,所以可能也是因为这个原因,这种巨大的蛋白质基本上是动态解聚的,降低合成出错可能,同时这些蛋白应该也是结构蛋白,因为再复杂的功能可以分步完成,没有必要冒着这么大风险合成如此巨大蛋白质。
然后介绍了肽是如何命名的,这里我不打算详细记录,因为很多情况我们也不会去看这么长的命名,简单来说就是我们把游离的氨基这一段作为起始点位,然后一次念组成的氨基酸。举一个小小三肽的例子,GAT,那么我们应该这么命名,甘氨酰丙氨酰苏氨酸,以此类推就好。
然后我们再来介绍肽的一些基本性质,这里没有考虑到肽在生理环境下的具体作用比如催产素(九肽)可以调节情绪,促甲状腺素释放因子(三肽)可以促进甲状腺素释放,仅仅是从氨基酸的角度来考虑。
那么我们在氨基酸这里讲到过氨基酸是有手性的(除Gly),那么这里同理,只要这个肽不是Gly组成的聚合体,那么这个肽就会存在手性。然后我们又介绍氨基酸等电点的定义和性质,这里也是相同的方式定义的,但是在这里因为单个肽上可能存在着多个可解离的基团(在R上),所以实际上去做滴定实验就会很困难,因为可能存在着多种带电状态,当然了,理论上仍然是可行的。但是与氨基酸性质不同的是,寡肽(>2)内部存在多个肽键,所以可以发生双缩脲反应。那么在高中我们也讲过双缩脲反应其实是Cu2+与肽键的配位反应,那么Cu2+一般需要4-6个的配位键可以达到稳定,那么单个的肽键只可以提供1个配位键(另外一个由OH-提供,可以简单认为提供一对吧),那么这也就是为什么二肽是没有办法发生双缩脲反应(没有办法形成稳定的五元环络合物)
但是我们根据这个反应机理也可以意识到,肽的空间结构可能也会对这个反应能否发生有着一定的影响的。
我们把天然存在的寡肽称之为活性肽(因为一般具有一定生理活性)可以有两种来源,一种是有基因编码,tRNA运输的,在核糖体合成的,那么对于这一种肽来说,所有的氨基酸都是L型的,还有一种活性肽是不在核糖体上进行合成的,是经过一系列酶促反应发生的,那么由于这里不涉及tRNA运输等等,所以这里的活性肽可以掺杂D型氨基酸,比如常见的有谷胱甘肽(有非常重要的生理意义)和细菌细胞壁的肽聚糖。
2. 蛋白质的结构
我们把仅仅由氨基酸组成的蛋白质称之为简单蛋白,含有非氨基酸成分的称之为缀合蛋白。那么这些非氨基酸成分可能会有:1.在氨基酸侧链上通过共价修饰引入的基团(回忆一下在氨基酸章节有提到过一般这些共价修饰是发生在极性氨基酸上的,因为可以更好调控蛋白质作用)2. 与蛋白质结合的无机成分,通常是一些金属离子(比如血红蛋白里面就结合了铁离子)3. 与蛋白质结合并不紧密的有机分子,称之为辅酶,4.与蛋白质结合紧密的有机分子,称之为辅基,后面三种非氨基酸成分是蛋白质行使功能所必需的,所以我们一般称之为辅因子,蛋白质可以分为一二三四四个结构层次,但是注意并不是所有蛋白质都是具有这四个层级的。
1. 蛋白质的一级结构
蛋白质的一级结构也称为蛋白质的共价结构,这是蛋白质最基本的结构或者说也是各个层次结构中最稳定的,因为蛋白质的一级结构的维持是依靠着共价键的作用。那么在一级结构中我们主要考虑的作用就是共价作用,包括了肽键和二硫键(一定要注意二硫键是共价键哦,所以是稳固一级结构的作用之一)
这里有必要去详细介绍一下肽键,因为在高中我们的认知就仅仅局限于肽键就是氨基和羧基拖说形成的键,然后用单键表示。但是我们需要知道,在化学当中,化学键只不过是形象表征原子之间相互作用的一种方式而已,所以即使肽键用单键表示,也只是因为综合考虑键能、键长、空间参数等等,认为单键占比更大而已。其实肽键中有40%可以认为是双键(这个比例也是综合考虑诸多因素得出的),为什么呢?因为在羰基的碳氧双键可以与碳氮单键之间发生共振,虽然羰基结构是更为稳定的共振式,但是另一种共振式的存在也赋予了肽键以双键的性质。肽键具有双键的性质更加重要的作用是使得与肽键有关的六个原子可以认为是处于同一个平面上的(这里我们需要考虑到一个参数为旋转能垒,肽键的旋转能垒大致在80-120kJ/mol,这在正常的生理环境下是几乎不可能旋转的),我们称这个平面是肽平面。这里截取杨荣武老师主编生物化学(第四版)的一幅图
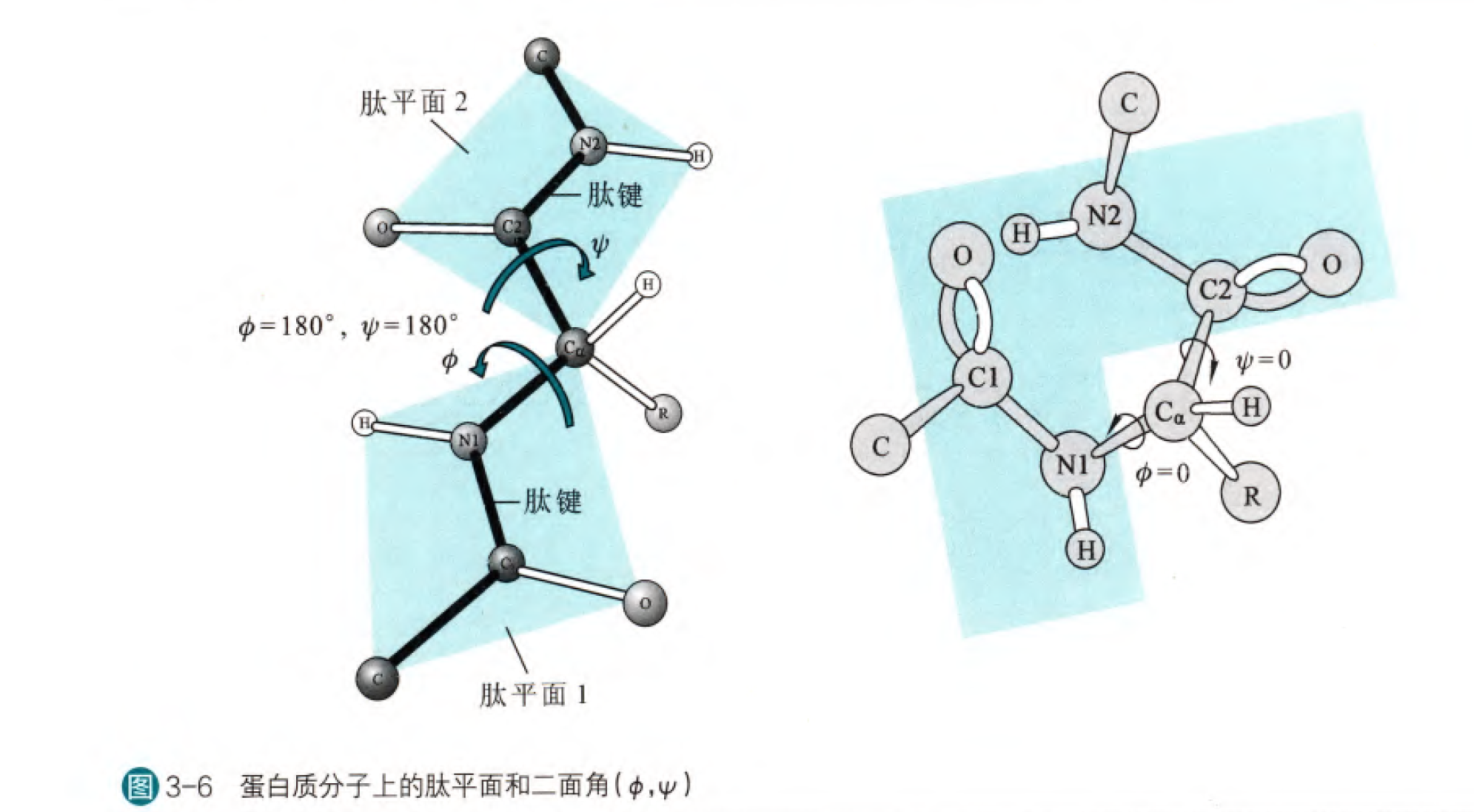
我们首先看右边这幅图,C1、N1、H、C、O和Cα都是在一个平面内,同理C2N2为中心的平面。那么我们把Cα与N1的键转动角度记为Phi角,Cα与C2的键转动角称为Psi角。先看Phi角,如果C1与C2是同平面顺式,那么此时Phi角记为0,同理如果N1与N2时是同平面顺式,那么Psi角记为0。我们从Cα向N1看过去,如果顺时针旋转键,那么phi为正,反之为负。从Cα向C2看过去,如果顺时针旋转键,那么Psi为正,反之为负。那么实际上Phi和Psi均为0度是几乎不能存在的,因为会有很大的空间位阻,这也是我们需要后面考虑肽平面二面角的重要因素。
那么我们可以想到,不是所有的Phi和Psi都是可以取到的,很重要的取决因素就是空间位阻,特别是由R基团引起的空间位阻。那么我们首先来看两个较为特别的例子,甘氨酸和脯氨酸。
甘氨酸的R仅仅是一个H原子,所以这就提供了甘氨酸残基以充分的自由旋转,所以甘氨酸所可以取到两个角度也就是最广的。但是反过来看脯氨酸,因为脯氨酸的氨基(实际上是亚氨基)正好和其的R形成一个五元环,所以由于这个环的限制,使得Cα-N1键基本上是固定的(本质上是因为原本更加自由的N现在受到五元环R侧C的连接因此受限,也就是原本N1旋转考虑到的是与R的空间位阻应当尽可能小,但是现在直接与R相连,那么考虑到的因素是保证肽平面各个夹角接近120度的同时使得环张力尽可能小,这就使得Phi角几乎被锁定在-60度,在此转角可以使得环张力尽可能小,但是为什么是-60度呢,首先解释60度是因为这个吡咯烷环是以半椅式构象存在,夹角接近60,取负是因为氨基酸的手性)
其实之前也有提到,顺式构象的空间位阻一般是较大的,所以巨大多数肽键都是采取反式构象。但是特例仍然是脯氨酸造成,由于脯氨酸特别的环结构,使得顺式和反式的能量差异其实不是很大(顺式比反式高2-4kJ/mol,其余氨基酸在12-14kJ/mol),所以肽键有实现顺式的可能。但是需要注意的是,在形成肽键(在核糖体合成的蛋白质,如果是在其他酶系统合成的多肽会有例外)的时候,所有的氨基酸都是以反式连接的(这是由于核糖体的立体选择性造成的),那么脯氨酸可以在以反式方式连接完成之后在肽基脯氨酰顺反异构酶(PPI)作用下转变为顺式。(从结构上看,甘氨酸形成顺式的比例也会相较于除脯氨酸的其他氨基酸而言较大)
那么,既然有些Phi和Psi的角度是不可以取的(其实能够取的大约只有10%),那么根据空间位阻等数据可以计算出哪些(Phi,Psi)是禁忌的,根据这个思路做出了Ramachandran图(具体不细说,因为涉及到的知识目前无法计算和求证)
如果我们知道了蛋白质的一级结构(氨基酸排列顺序)同时也知道了各对(Phi,Psi)那么我们其实就已经知道了这个蛋白质的三维结构,但是由于蛋白质的二面角受到了很多作用力的影响,所以实际计算有很大的困难。

)




Modbus)


)
- Weblogic SSRF漏洞)


)

)



![[光学原理与应用-422]:非线性光学 - 计算机中的线性与非线性运算](http://pic.xiahunao.cn/[光学原理与应用-422]:非线性光学 - 计算机中的线性与非线性运算)