自十七年前诱导多能干细胞(也称iPS细胞或iPSC)技术出现以来,干细胞生物学和再生医学取得了巨大进展。人类iPSC已广泛用于疾病建模、药物发现和细胞疗法开发。新的病理机制已被阐明,源自iPSC筛选的新药正在研发中,并且首次使用人类iPSC衍生产品的临床试验已经启动。特别是,人类iPSC技术与基因编辑和三维类器官的最新发展相结合,使得基于iPSC的平台在其各个应用领域(包括精准医学)变得更加强大。
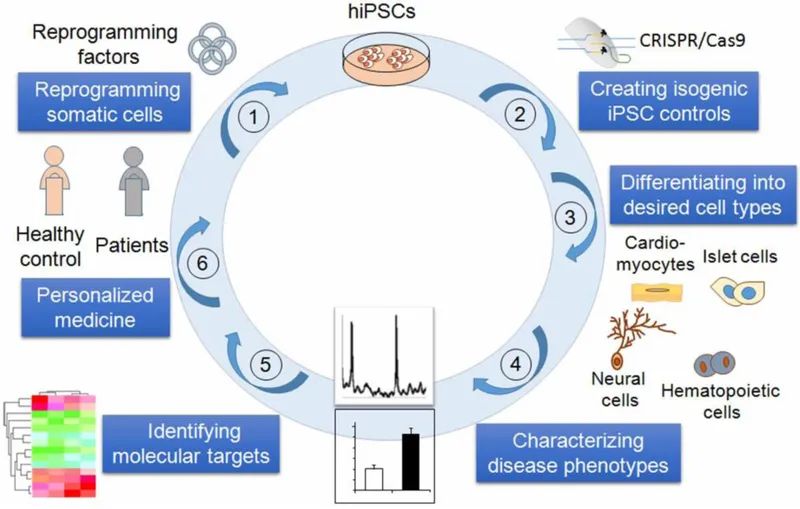
图1 基于人类iPSC的疾病建模示意图(Shi et al., 2017)。
iPSC简介
京都大学山中实验室于2006年首次报道了使用四种转录因子的混合物从小鼠体细胞(如成纤维细胞)中产生具有与胚胎干细胞(ESC)相似的基因表达/表观遗传特征和发育潜力的细胞,这些细胞被称为iPSC,可分化为三个胚层(内胚层、外胚层和中胚层),四种因子:Oct4、Sox2、Klf4和c-Myc被命名为“Yamanaka因子”,统称为OSKM。2007年,Yamanaka团队成功地将人类体细胞转化为与人类ESC(hESC)具有相似基因表达谱和多能性的干细胞,这些细胞被称为人类iPSC(hiPSC)。此后,iPSC引起了毒理学、病理学、病毒学、发育解剖学和生理学等领域的研究人员的广泛兴趣。Shinya Yamanaka与Sir John Gurdon也因“发现成熟细胞可以被重新编程成为多能细胞”而荣获2012年诺贝尔生理学或医学奖。
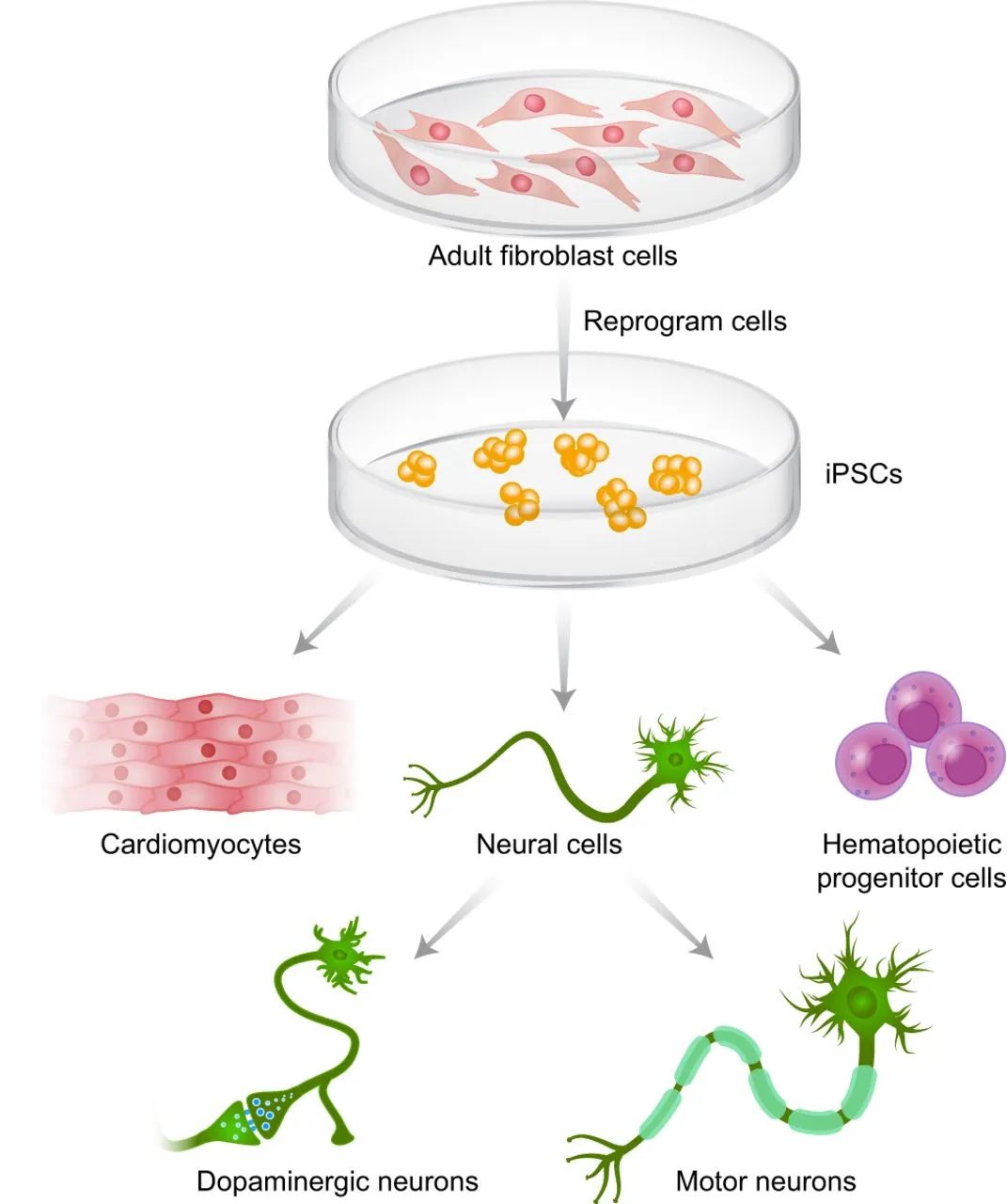
图2 iPSC的产生和分化(Borger et al., 2017)。
在此之前,由于干细胞免疫排斥以及社会伦理问题导致人类干细胞的开发之路并不顺畅。当iPSC诞生时,科学界为之振奋。与其他来源的干细胞不同,iPSC是通过逆转录病毒载体将4个转录因子导入成熟体细胞中,之后重新编码,从而获得具有多分化潜能的干细胞,完美规避了免疫排斥和伦理问题。iPSC的优点主要体现在三个方面:一是iPSC与人胚干细胞的特征高度相似(并不完全等同,在性能上有略微差异),可以在体外无限复制,适用于大规模培养;二是iPSC可根据需求诱导分化成需要的细胞株,且批次间特性相对稳定,可避免临床疗效不一致情况的发生;三是iPSC细胞的来源是成体细胞,既避免了伦理问题,又易于获取。如果iPSC来源于患者自身,还可减小免疫排斥问题。但目前iPSC技术仍存在分化效率较低、致瘤安全风险待验证、异体诱导仍具有免疫原性等问题。
iPSC在疾病中的应用
Clinicaltrials.gov数据库(https://www.clinicaltrials.gov/)检索发现,共有86项iPSC临床试验,2015年,iPSC相关临床试验数量有显著提升,2018年达到峰值并有所回落。其中,最快的已进入Ⅲ期临床(Cynata Therapeutics),但大部分仍处于Ⅰ期临床及临床前阶段。下面,就和伯小医一起了解iPSC在各类疾病中的研究进展吧!
一、iPSC与肿瘤
嵌合抗原受体(CAR)-T细胞疗法已成为恶性肿瘤治疗中最有前途的治疗策略之一,迄今为止,已有六款CAR-T细胞产品获得美国食品药品监督管理局(FDA)批准用于治疗B细胞白血病/淋巴瘤和多发性骨髓瘤。然而,接受CAR-T细胞治疗的患者必须面对一些风险,包括细胞因子释放综合征(CRS)和免疫效应细胞相关神经毒性综合征(ICANS)以及移植物抗宿主病(GVHD)。
介于iPSC具有无限的增殖能力,同时保持其多能性和谱系分化潜力,因此,可产生具有不同纯合人类白细胞抗原(HLA)组合的iPSC系库,根据宿主和移植物之间的HLA匹配选择最佳的iPSC来源,可降低源自自身CAR-T细胞的免疫排斥风险。另一种选择是使用基因编辑来消除HLA-I和/或HLA-II表达。使用iPSC的一个优点是,CAR-T细胞可以从具有克隆扩增能力的单个iPSC克隆中产生,因此它们所经历的遗传修饰在最终细胞群中将是同质的。
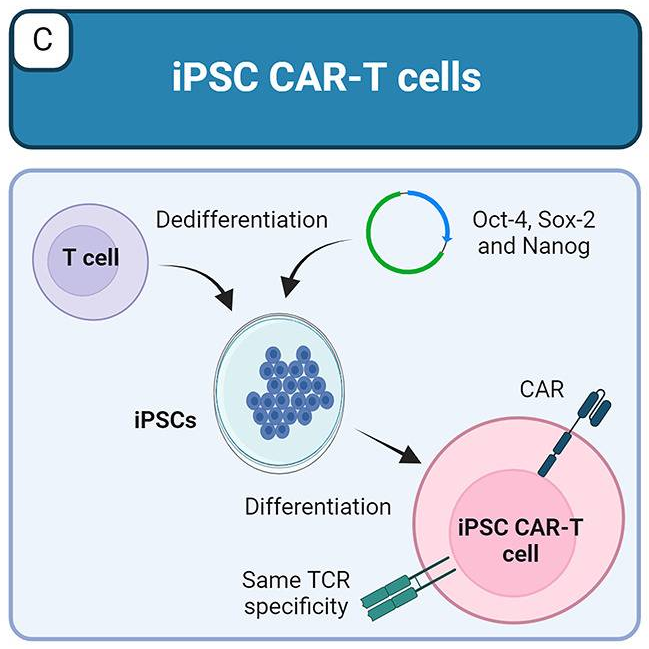
图3 iPSC生产抗肿瘤同种异体CAR-T细胞策略(Aparicio et al., 2023)。
为了解决免疫排斥问题,Wang等人研发了iPSC衍生的CAR-T细胞,其不仅缺乏HLA-I和HLA-II,还缺乏脊髓灰质炎病毒受体CD155,编码NK细胞激活受体DNAM-1配体,诱导HLA-E的表达,从而防止了NKG2A+NK细胞的排斥。
二、iPSC与免疫性疾病
利用免疫相关疾病患者来源的iPSC进行基础研究预计将成为阐明免疫性疾病发病机制和药物发现的有前景的平台。由于自身炎症性疾病通常是单基因的,基因突变会影响细胞功能,患者来源的iPSC往往表现出疾病特异性表型。特别是,iPSC衍生的单核细胞和巨噬细胞可用于功能实验。借助iPSC技术,研究人员可以轻松获取人体细胞并使用人体样本研究疾病,并且使用iPSC研究人类免疫相关疾病与传统研究方法相比具有明显的优势,尤其是自身免疫性疾病(图4)。
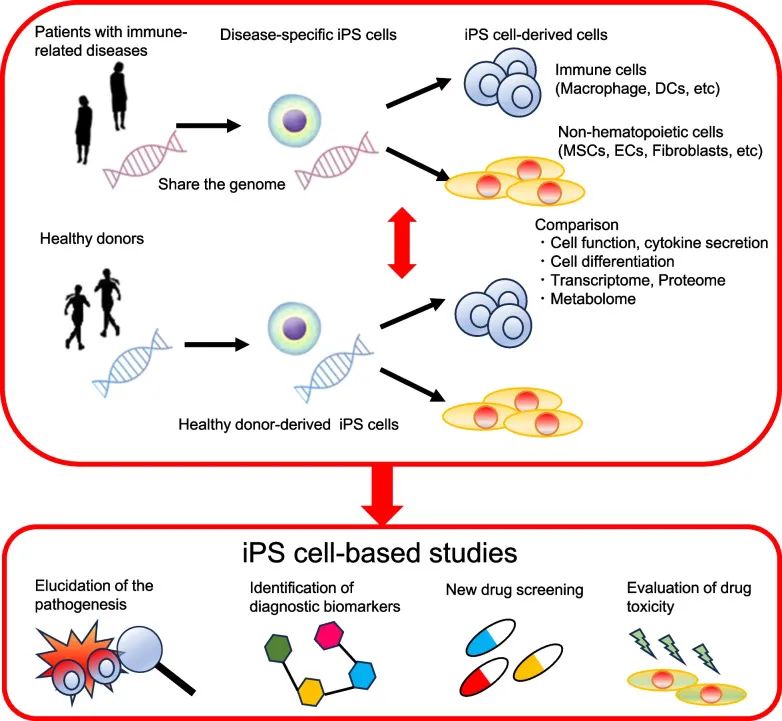
图4 使用患者来源的iPSC研究免疫相关疾病的示意图(Shoda et al., 2023)。
为了研究自身免疫性疾病的发病机制,利用iPSC来源的细胞建立体外疾病模型至关重要。由iPSC分化而来的单核细胞和巨噬细胞经常被用来分析免疫相关疾病的表型。免疫相关疾病是由免疫系统失调引起的,其中,自身炎症性疾病的特点是发病机制中促炎细胞因子发挥关键作用,免疫相关基因的突变直接导致疾病,如:周期性发烧综合症、干扰素病以及其他新发现的单基因自身炎症性疾病。而自身免疫性疾病却恰好与自身炎症性疾病相反,由抗原特异性免疫反应失调而引起,如:自身免疫性甲状腺炎、系统性红斑狼疮(SLE)、类风湿关节炎(RA)、强直性脊柱炎(AS)、白塞氏病(BD)、干燥综合征(SS)、系统性硬化症(SSc)等。
自身炎症性疾病通常是单基因的,因此患者来源的iPSC可以表现出与疾病相关的表型,即自身炎症性疾病患者来源的iPSC可用于生物标志物发现和药物筛选。而自身免疫性疾病是多基因的,多种低影响因果变异的积累促进了自身免疫和致病过程,就自身免疫性疾病患者来源的iPSC而言,个体风险基因的影响往往是微妙的,识别致病基因成为一项挑战,特别是因为健康供体来源的iPSC和自身免疫性疾病患者来源的iPSC之间存在差异。虽然环境因素诱发疾病的机制非常复杂且难以在体外复制,但可以使用基于iPSC的研究来评估其影响。尽管基于患者iPSC对自身免疫性疾病的研究存在局限性,但许多采用创新策略的引人注目的研究已经发表。
三、iPSC与线粒体疾病
线粒体疾病是一组影响任何年龄、任何器官的遗传性疾病,由细胞核和线粒体基因(如线粒体DNA(mtDNA))突变引起,通常是多系统疾病,影响能量需求高的组织或器官(如:神经系统、心脏和骨骼肌),也表现为单一器官和组织(如:耳朵和眼睛)。目前,已经建立了许多针对线粒体疾病的患者来源的iPSC模型(图5)。
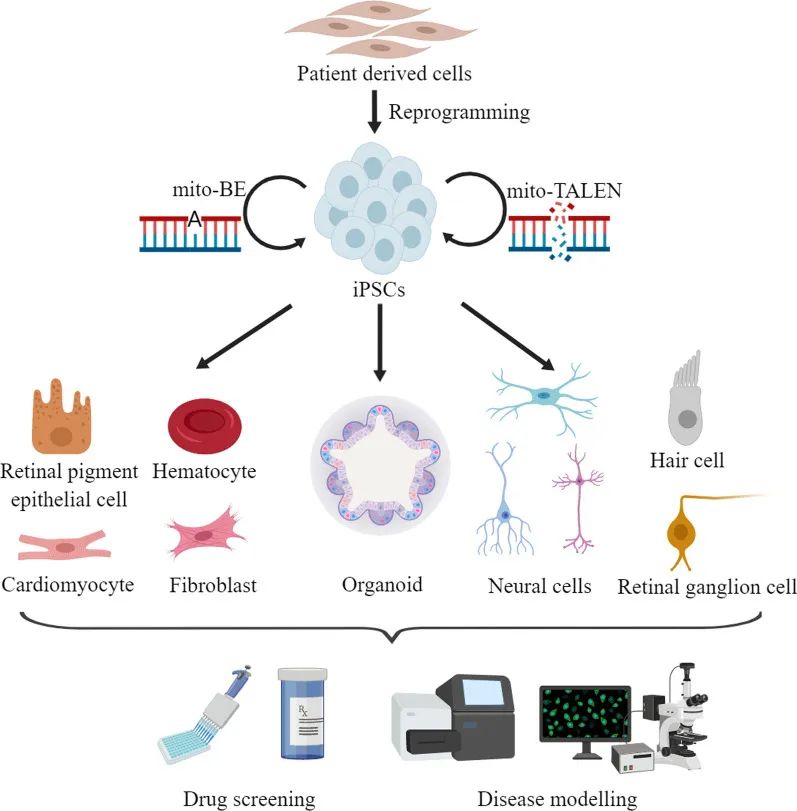
图5 患者源iPSC模型的建立(Chen C and Guan M X., 2023)。
有学者指出,针对iPSC中的mtDNA进行碱基编辑,可能能够生成线粒体疾病模型并开发潜在的治疗干预措施。但事实上,依赖sgRNA的传统CRISPR/Cas系统与线粒体不相容,2020年,Liu等人设计了无活性split-DddA,可催化人mtDNA中的C•G到T•A的转化。2022年,Kim等人利用TALE改造了源自细菌TadA蛋白的脱氧腺苷脱氨酶,以催化A到G的转化,扩展了mtDNA碱基编辑的应用范围。iPSC技术与基因编辑技术的结合将为生成疾病模型和开发这些疾病的有效治疗方法提供强大的工具(图6)。
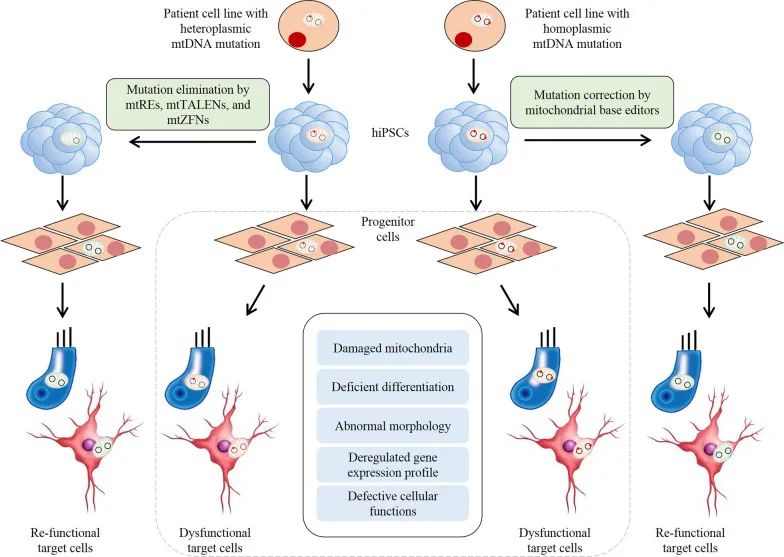
图6 将iPSC与mtDNA基因编辑技术相结合的治疗方法(Chen C and Guan M X., 2023)。
参考文献
Aparicio C, Acebal C, González-Vallinas M. Current approaches to develop “off-the-shelf” chimeric antigen receptor (CAR)-T cells for cancer treatment: a systematic review[J]. Experimental Hematology & Oncology, 2023, 12(1): 73.
Borger D K, McMahon B, Roshan Lal T, et al. Induced pluripotent stem cell models of lysosomal storage disorders[J]. Disease models & mechanisms, 2017, 10(6): 691-704.
Chen C, Guan M X. Induced pluripotent stem cells: ex vivo models for human diseases due to mitochondrial DNA mutations[J]. Journal of Biomedical Science, 2023, 30(1): 82.
Shi Y, Inoue H, Wu J C, et al. Induced pluripotent stem cell technology: a decade of progress[J]. Nature reviews Drug discovery, 2017, 16(2): 115-130.
Shoda H, Natsumoto B, Fujio K. Investigation of immune-related diseases using patient-derived induced pluripotent stem cells[J]. Inflammation and Regeneration, 2023, 43(1): 51.
















 编译器gcc/g++、动静态库感性认识、自动化构建-make/Makefile)


