在微生物实验中,细菌浓度的精准测定和菌种的准确鉴定是两项基础且核心的操作。本文将详细介绍相关技术的原理、操作步骤及注意事项,为新手提供系统性指导。
一、细菌浓度测定方法
1. 光密度法(OD600):快速定量的首选
原理
OD600 测定基于光散射原理:当 600nm 波长的光穿过菌液时,细菌会对光产生散射,散射强度与菌液中细菌浓度在一定范围内(通常 0.1-0.8 OD 值)呈线性正相关。需注意,超过此范围后线性关系会偏离,例如大肠杆菌在 OD600>0.8 时,数据准确性显著下降。
操作步骤
- 仪器校准:以空白培养基作为对照调零,建议使用中性密度滤光片验证仪器精度;固定使用同一台仪器,并记录比色皿光程(通常为 1cm)。
- 样品准备:轻柔混匀菌液(避免产生气泡影响测定),若 OD 值超过 0.8,需用无菌培养基稀释至 0.1-0.8 范围后再测定。
- 测量操作:用擦镜纸清洁比色皿外壁,每个样品读取 3 次取平均值,以减少误差。
- 浓度计算:最终浓度 = 测定 OD 值 × 稀释倍数。建议提前绘制 OD 值与活菌数(CFU)的标准曲线,便于直接换算活菌浓度。
注意事项
- 若培养基颜色较深,可通过离心收集细菌沉淀,用 PBS 洗涤后重悬再测定,避免背景干扰。
- 不同仪器的测定结果存在差异,需固定仪器并定期校准,记录光程参数以保证数据可比性。
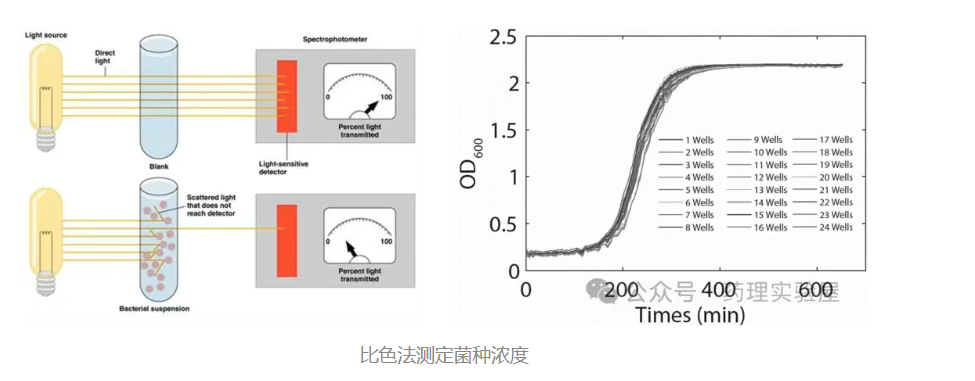
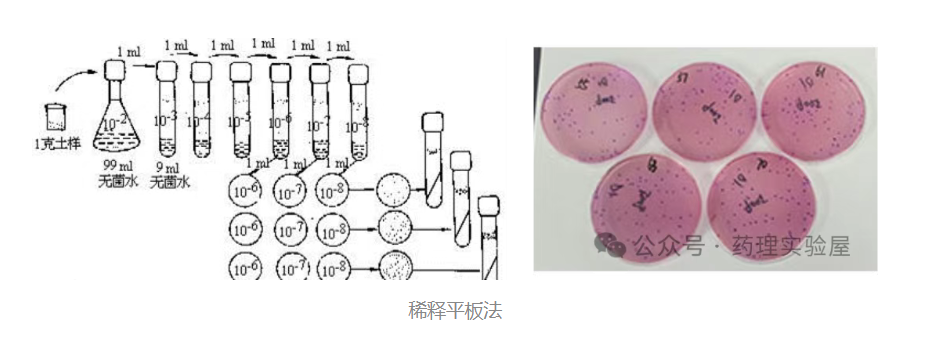
2. 平板计数法:活菌定量的 “金标准”
核心概念:CFU
CFU(菌落形成单位)指能在固体培养基上形成一个菌落的活细菌个体(可能是单个细菌或团聚的细菌群),仅反映活菌数量,是活菌定量的直接方法。
计算公式
plaintext
CFU/mL =(菌落数 × 稀释倍数)÷ 接种体积(mL)
操作流程
- 样品稀释:采用无菌生理盐水或 PBS 进行 10 倍梯度稀释(如 10⁻¹ 至 10⁻⁸),每稀释度更换无菌枪头,防止交叉污染。
- 培养基制备:选择适宜的固体培养基(如 LB 琼脂),灭菌后冷却至 50℃左右倒平板,90mm 直径平板的培养基用量约 20mL,厚度均匀可保证菌落生长一致性。
- 接种方法:
- 涂布法:取 100μL 稀释液滴加至平板,用无菌涂布棒均匀涂布。
- 倾注法:取 1mL 稀释液与融化的琼脂培养基混合后倒平板。
- 培养条件:根据细菌特性设置温度(通常 30-37℃),培养 18-48 小时,保持培养环境湿度适宜。
- 计数规则:选择菌落数在 30-300 之间的平板计数,菌落数过少或过多均会导致结果偏差,可借助菌落计数器提高效率。
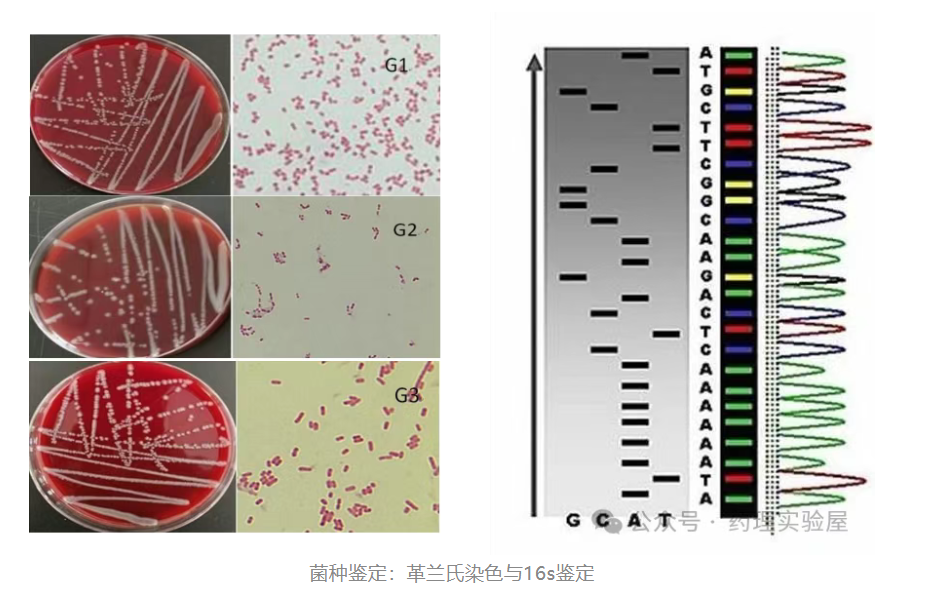
二、菌种鉴定技术
1. 传统鉴定方法
革兰氏染色:细胞壁特性鉴别
- 原理:革兰阳性菌细胞壁较厚,含肽聚糖多,与结晶紫结合稳定,经酒精脱色后仍保留紫色;革兰阴性菌细胞壁薄,肽聚糖少,结晶紫易被洗脱,复染后呈红色。
- 操作要点:
- 涂片厚度适中,避免重叠影响观察。
- 染色步骤严格控制时间:结晶紫染色 1 分钟→碘液媒染 1 分钟→酒精脱色 30 秒(关键步骤,时间需精准)→番红复染 30 秒。
氧化酶试验:呼吸类型辅助判断
- 原理:检测细菌是否含细胞色素 c 氧化酶,阳性菌可使四甲基对苯二胺试剂在 30 秒内变蓝,阴性菌无颜色变化。
- 注意事项:使用新鲜培养的细菌,避免用含铁工具接触试剂,防止假阳性。
2. 分子鉴定方法:精准到种级
16S rRNA 测序:细菌 “分子身份证”
- 原理:16S rRNA 基因在细菌中高度保守且种间存在特异性差异,长度约 1500bp,数据库完善,通过序列比对可实现精准鉴定。
- 操作关键:
- DNA 提取:选用对数期细菌(OD600≈0.6),革兰阳性菌需用溶菌酶预处理以破坏细胞壁,提取后用 RNase 去除 RNA 污染。
- PCR 扩增:常用引物 27F(5'-AGAGTTTGATCMTGGCTCAG-3')和 1492R(5'-TACGGYTACCTTGTTACGACTT-3');反应程序:94℃预变性 5 分钟,35 个循环(94℃变性 30 秒→55℃退火 30 秒→72℃延伸 90 秒),最后 72℃延伸 10 分钟。
- 序列分析:拼接测序结果后,通过 NCBI BLAST 等工具与数据库比对,确定菌种分类。
总结
细菌浓度测定中,OD600 法适合快速定量,平板计数法适合活菌精准计数,两者可结合使用(如通过标准曲线关联 OD 值与 CFU)。菌种鉴定方面,传统方法(革兰氏染色、生化试验)可快速初步分类,分子方法(16S rRNA 测序)可实现精准鉴定。实际操作中需根据实验目的选择合适方法,并严格遵循无菌操作与实验规范,以保证结果可靠性。
通过掌握上述基础技术,可为后续微生物功能研究、发酵优化等实验奠定坚实基础。
数据库容量规划)
)







)





完全指南:从入门到精通)



详解)