CD8⁺T细胞耗竭(T cell exhaustion)是肿瘤免疫治疗的核心瓶颈,其表观遗传重塑机制(如组蛋白修饰)是当前国自然重点资助的前沿方向。耗竭T细胞(TEX)是指在慢性感染(如持续性病毒感染)或肿瘤微环境中长期暴露于抗原刺激后,功能逐渐失调的CD8⁺T细胞。研究显示其在癌症和慢性病毒感染中经历代谢和表观遗传重塑,削弱了其保护能力。然而,营养代谢对控制TEX分化的表观遗传修饰的影响尚不清楚。今天我们带来一篇Science文章《Nutrient-driven histone code determines exhausted CD8+ T cell fates》,该研究针对肿瘤免疫治疗的核心瓶颈——CD8+T细胞耗竭(TEX)展开,首次揭示代谢重编程通过营养依赖的组蛋白修饰决定T细胞分化命运。

-
研究技术:RNA-seq、CUT&Tag、scRNA-seq等(爱基百客均可提供)。
-
核心问题:本研究揭示了乙酰辅酶A合成酶ACSS2和ATP-柠檬酸裂解酶ACLY通过介导不同营养源(乙酸盐vs.葡萄糖)驱动的组蛋白乙酰化,决定TEX细胞分化命运的关键机制。
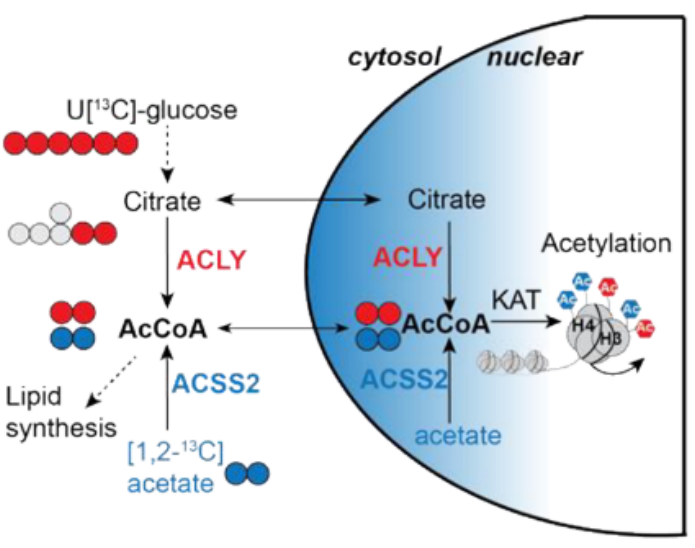
研究思路
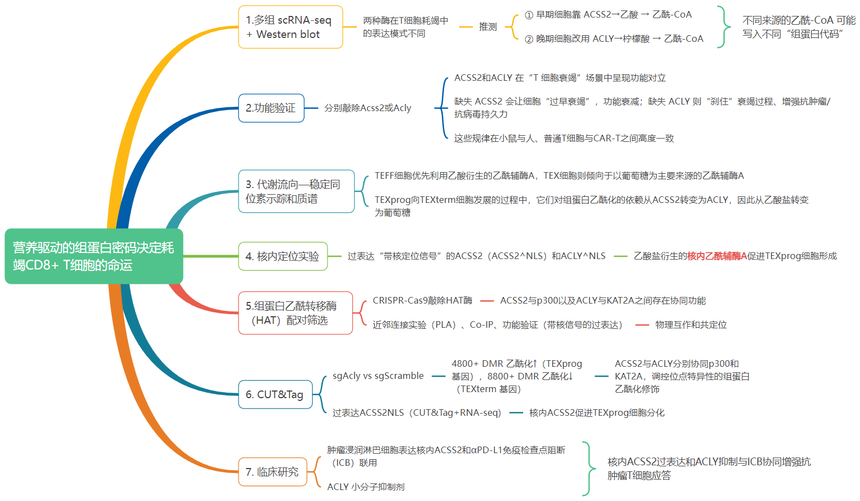
研究结果
1. ACSS2与ACLY在TEFF(效应T细胞)和TEX细胞中的差异表达模式
为了理解选择性营养物质利用及随后的乙酰辅酶A(acetyl-CoA)生成如何调节CD8+T细胞分化,研究分析了从肿瘤或急性(Armstrong)与慢性(克隆13)淋巴细胞性脉络丛脑膜炎病毒(LCMV)感染中分离出的CD8+T细胞中乙酰辅酶A合成酶Acss2和ATP-柠檬酸裂解酶Acly的转录谱(公共单细胞转录组数据,图1A和1B)。另外,研究还从蛋白水平关注了ACSS2与ACLY的表达情况(图1C和1D)。结果表明,随着TEX细胞在肿瘤和慢性感染中发展,它们下调ACSS2表达同时维持ACLY表达。这里研究团队发现了这两种酶在T细胞耗竭中的表达模式不同。
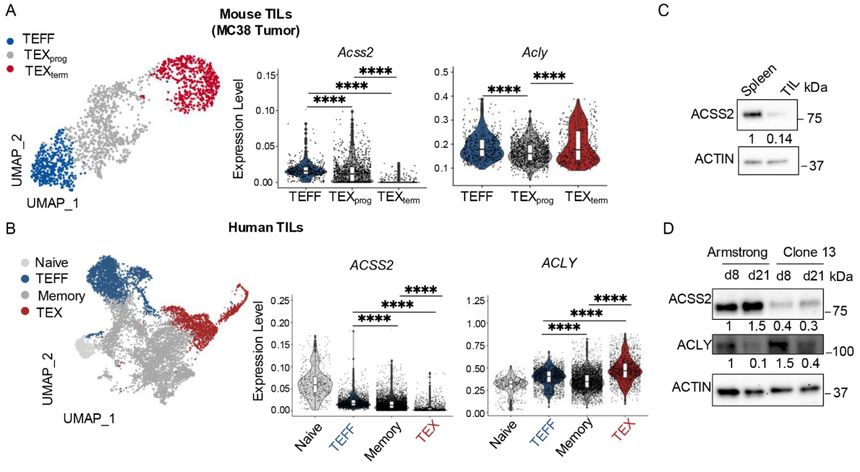
图1:ACSS2表达下调,而ACLY表达在TEX细胞中持续存在。
2. ACSS2和ACLY在TEFF和TEX细胞分化及抗肿瘤和抗病毒免疫中的功能拮抗
使用基因敲除方法研究了ACSS2和ACLY在肿瘤发生和慢性LCMV感染期间TEX细胞形成中的作用。在导致T细胞耗竭的情况下,Acss2的缺失削弱了CD8+T细胞活性,而Acly缺失则增强了它们的功能。
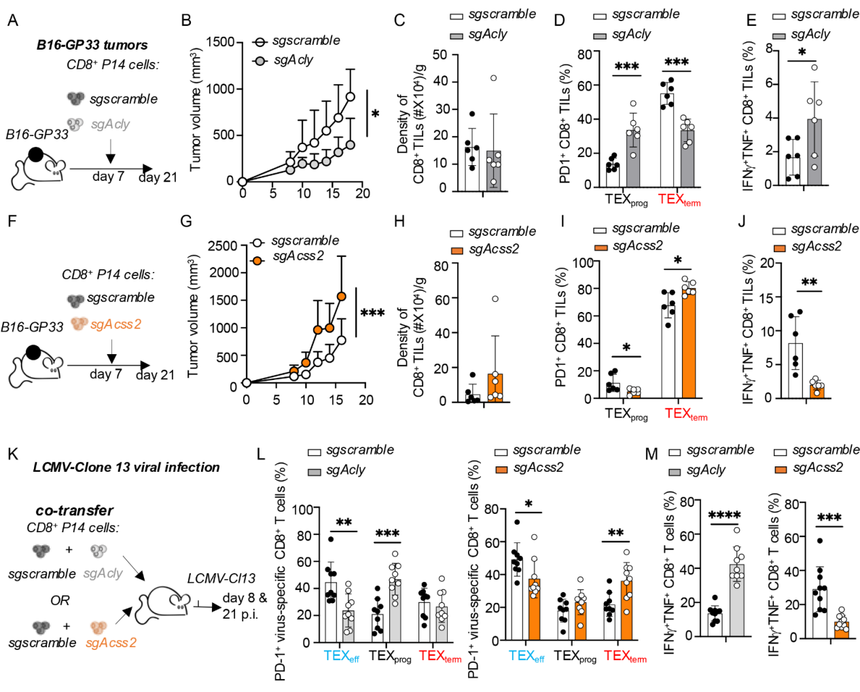
图2:ACSS2促进TEXprog细胞形成及抗肿瘤/抗病毒反应,而ACLY则起抑制作用。
3. ACSS2与ACLY决定了TEFF和TEX细胞对底物的选择性利用
ACSS2和ACLY的差异表达模式及其对TEX细胞形成的影响让研究团队提出假设,即乙酸盐和葡萄糖衍生柠檬酸盐合成乙酰辅酶A的过程可能在功能性效应T细胞和功能障碍性耗竭T细胞之间存在差异。于是,研究团队使用稳定同位素示踪实验来追踪乙酰辅酶A的来源。数据表明TEX细胞倾向于利用葡萄糖而非乙酸生成细胞核乙酰辅酶A,这与ACSS2表达降低相一致。
4. ACSS2和ACLY分别在TEFF和TEX细胞中协调乙酸盐和葡萄糖介导的组蛋白乙酰化作用
为了研究乙酸盐和葡萄糖如何被利用来乙酰化组蛋白,利用同位素示踪([1,2-13C] acetate 或 [U-13C] glucose)追踪乙酰基的流向,并结合质谱、流式/质谱流式分析特定组蛋白乙酰化位点。结果表明TEFF细胞优先利用乙酸衍生的乙酰辅酶A来完成所有检测到的组蛋白乙酰化位点修饰(图3F),而TEX细胞则倾向于以葡萄糖为主要来源(图3G)。此外,在CD8+T细胞中敲除Acss2和Acly显示,与对照组或缺失Acly的细胞相比,缺乏Acss2的TEXprog细胞基于流式细胞术测量的H3K27ac总量降低了近50%,这强调了TEXprog细胞对ACSS2在维持全局组蛋白乙酰化水平方面的高度依赖性(图3H)。相比之下,Acly的缺失对TEXprog或TEXterm细胞的全局H3K27ac水平没有影响。实际上,它在TEXterm细胞中趋向于增加H3K27ac(图3H),这可能是由于在Acly缺陷细胞中观察到ACSS2的代偿性增加(图3I)。
此外,来自13C-乙酸盐的组蛋白乙酰化在sgAcss2 CD8+ T细胞中受损,而在sgAcly细胞中增加(图3J),这再次与ACSS2代偿一致(图3I)。相反,来自13C-葡萄糖的组蛋白乙酰化在sgAcly或sgAcss2 T细胞之间没有显著差异。这些发现表明,随着CD8+T细胞从TEFF分化为TEX细胞,或更准确地说,从TEXprog向TEXterm细胞发展的过程中,它们对组蛋白乙酰化的依赖从ACSS2转变为ACLY,因此从乙酸盐转变为葡萄糖。然而,TEX细胞无法维持与其功能更强的对应细胞(TEFF和TEXprog细胞)相同的全局组蛋白乙酰化水平。
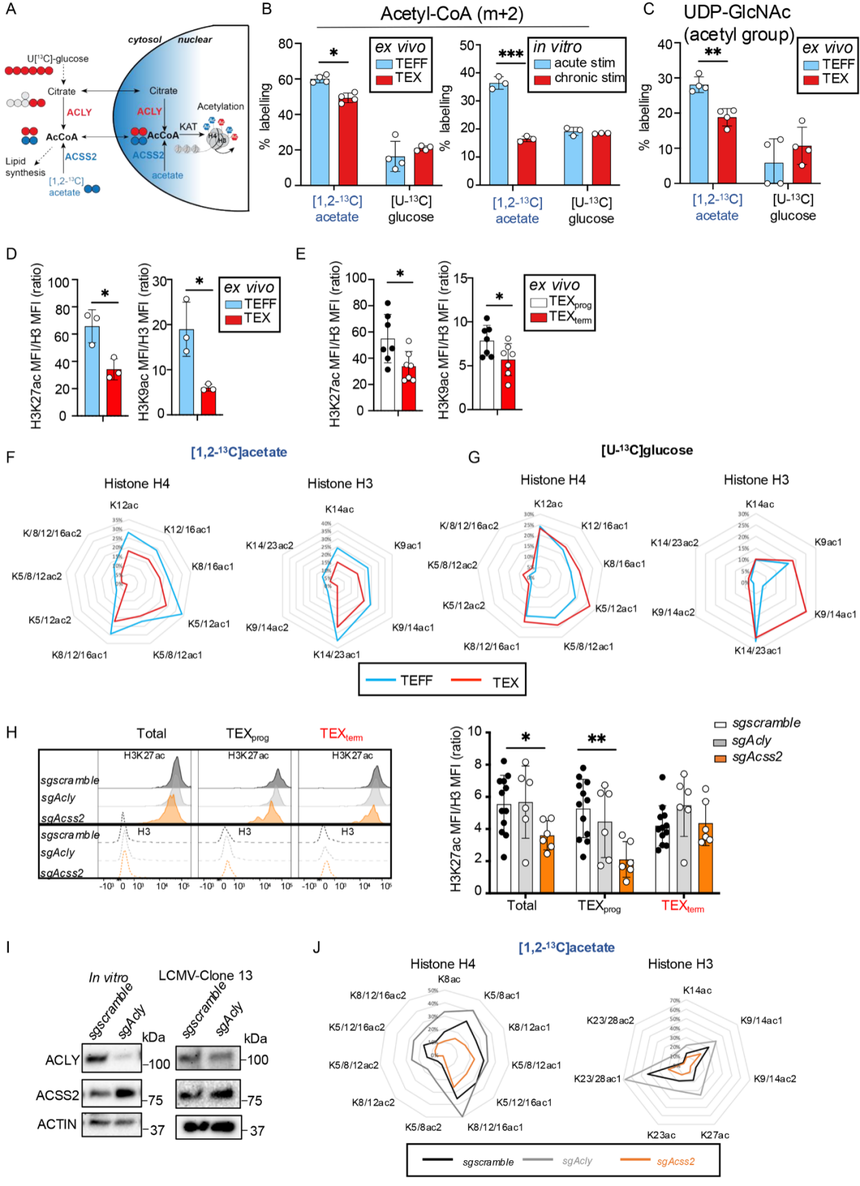
图3:ACSS2与ACLY在效应T细胞(TEFF)和耗竭T细胞(TEX)中差异调控乙酰辅酶A生成及组蛋白乙酰化修饰。
5. 乙酸盐衍生的核内乙酰辅酶A促进TEXprog细胞形成
为确定乙酸介导的组蛋白乙酰化和TEXprog细胞分化是否由ACSS2介导的局部核内乙酰辅酶A产生驱动,研究构建了FLAG标记的ACSS2WT、ACSS2NLS(核定位信号标记)和ACSS2NES(核输出信号标记)的RV过表达载体,并转导体外激活的P14+CD8+T细胞。这些构建体在CD8+T细胞中产生了类似水平的ACSS2,且具有预期的细胞定位。乙酸依赖性组蛋白乙酰化在ACSS2NLS过表达的CD8+T细胞中最为显著,证明了核内ACSS2的直接表观遗传效应。研究用这三种ACSS2 RV或空载体(EV,pMIG)对照转导P14+ sgAcss2 CD8+ T细胞,并将供体细胞转移到随后感染LCMV-clone 13的小鼠体内。与EV对照和ACSS2NES过表达细胞相比,ACSS2WT和ACSS2NLS过表达的P14+sgAcss2 CD8+T细胞增加了总体和TEXprog供体P14+细胞的比例以及它们产生IFNγ和TNF的能力,尽管ACSS2NLS过表达的效果更为显著。综上所述,这些发现强调了乙酸衍生的核内乙酰辅酶A在组蛋白乙酰化和TEXprog细胞形成及功能中的关键作用。
6. ACSS2与ACLY分别与p300和KAT2A共定位
核内乙酰辅酶A通过组蛋白乙酰转移酶(HAT)的活性来修饰组蛋白。鉴于ACSS2和ACLY对TEX细胞分化和组蛋白乙酰化的影响,作者研究了ACSS2、ACLY与特定HAT之间潜在的协同作用。在P14+CD8⁺T细胞里,用CRISPR-Cas9把常见HAT基因逐一敲掉,再放入LCMV-clone 13慢性感染小鼠,看缺哪个HAT会改变 TEXprog/TEXterm的比例。结果显示,sgEp300和sgCrebbp增强了TEXterm细胞的形成,这与sgAcss2的作用相似;而sgKat2a则促进了TEXprog细胞的形成,这与sgAcly的作用类似(图4A)。这些数据表明,ACSS2与p300(由Ep300编码)或CBP(由Crebbp编码)之间,以及ACLY与KAT2A之间存在协同功能。
尽管p300和CBP在结构和功能上密切相关,通常被合称为p300/CBP,但作者将p300作为ACSS2的功能伙伴进行重点研究,因为在LCMV-克隆13感染期间,与sgCrebbp相比,sgEp300在增强TEXterm细胞和扩增病毒特异性CD8+T细胞方面表现出更强的效果(图4A)。相应地,p300蛋白在急性刺激的细胞中水平升高,而KAT2A在慢性刺激的细胞中水平上调,这与ACSS2和ACLY的蛋白水平及其各自对TEXprog与TEXterm细胞分化的影响相一致。然后,研究关注了蛋白共定位与相互作用。近邻连接实验(PLA)测“距离<40nm的蛋白”会亮,结果显示在TEFF(急性刺激)里,只看到ACSS2+p300的红点;在TEX(慢性刺激)里,只看到ACLY+KAT2A的红点;把ACSS2或ACLY敲掉,红点消失,证明特异(图4B和C)。Co-IP+Western blot实验和荧光显微镜也进一步证明内源性ACLY在TEX细胞中与KAT2A相互作用,但不与p300相互作用,而ACSS2在TEFF细胞中特异性地与p300共定位,但不与KAT2A共定位。
研究还进行了功能验证,在细胞里过表达“带核定位信号”的ACSS2(ACSS2^NLS),再把p300敲掉,TEXprog细胞积累还是起不来,说明ACSS2必须借p300才有作用;类似地,过表达ACLY^NLS+再敲Kat2a,则TEXprog得以“救回来”,说明ACLY的促TEXterm效应依赖KAT2A。ACSS2^NLS或ACLY^NLS本身都会提高H3K27ac水平,但前提分别是p300或KAT2A存在。
总体而言,这些结果表明ACSS2向p300提供核定位的乙酰辅酶A,促进TEXprog细胞的发育。然而,随着慢性刺激ACSS2的丰度下降,ACLY提供的乙酰辅酶A支持KAT2A的催化活性占主导地位,促进TEXterm细胞的形成。
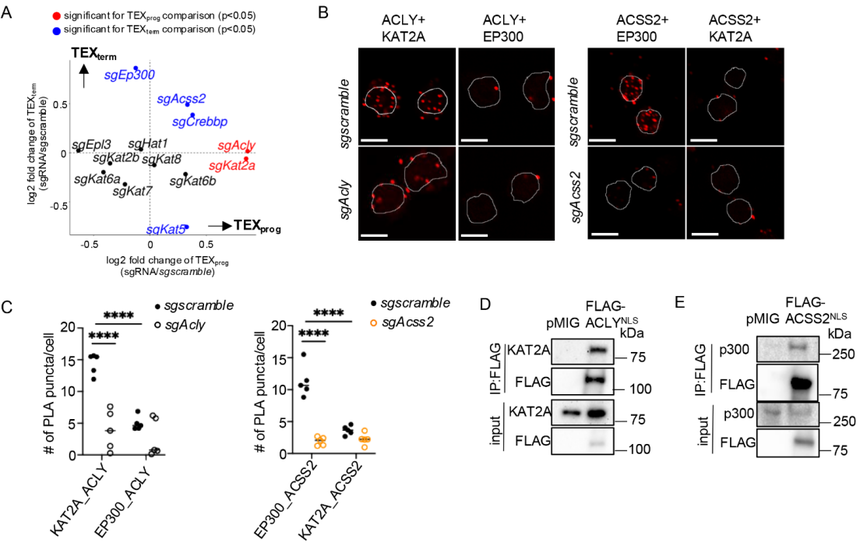
图4:ACSS2与ACLY分别与p300和KAT2A发生相互作用。
7. ACSS2与ACLY分别协同p300和KAT2A,共同调控组蛋白乙酰化修饰
基于上面的数据,作如下假设:ACSS2-p300复合物通过控制特定基因位点的组蛋白修饰,来调控与TEXprog细胞相关的基因表达;而ACLY-KAT2A复合物则可能控制着决定TEXterm细胞分化的基因位点的乙酰化。在感染后第21天分选两类CD8⁺T细胞,做CUT&Tag测序,分别构建H3K27ac、H3K9ac、H4ac的差异修饰区域(DMR)的全基因组图谱。将DMR与其邻近基因进行关联分析后发现,TEXprog和TEXterm细胞中,各自“特征”基因(例如,TEXprog的Tcf7、Bach2和TEXterm的Havcr2、Il10)的乙酰化水平均有升高。但从全基因组角度看,TEXterm的乙酰化总量低于TEXprog(呼应前文流式检测)。
研究在P14+CD8+T细胞中敲除了Acss2、Acly、Ep300和Kat2a,并检查了它们在体外或体内的TEX分化,并对H3K27ac、H3K9ac和H4ac进行了CUT&Tag。如预期,由于慢性刺激的CD8+T细胞中ACSS2自然含量较低,sgAcss2和sgscramble CD8+T细胞之间观察到的差异修饰区域(DMR)很少。相比之下,将sgAcly细胞与对照组比较,约4838个DMR在H3K27ac、H3K9ac和H4ac上表现出同步增加,包括许多TEXprog特征位点(如Tcf7、Il7R、Sell、Tnf和Id3),而约8793个DMR在TEXterm特征基因位点(如Il10、Runx3、Havcr2和Entpd1)表现出同步减少(图5A和B)。
基因集富集分析(GSEA)进一步证实了sgAcly细胞中TEXprog分化的增强(图5C)。Motif分析显示,sgAcly T细胞中乙酰化增加的DMR高度富集于AP1-bZIP转录因子结合基序(如Fos、Jun、AP-1和ATF),这些与T细胞激活、效应功能以及防止CD8+T细胞耗竭相关,而乙酰化减少的DMR则富集于ETS转录因子家族成员(图5D)。此外,Acly和Kat2a依赖的H3K27ac DMR的全基因组重叠揭示了几个共同靶向位点,包括许多TEXterm位点。相比之下,sgAcly细胞中上调的DMR(作为Acss2依赖位点的代表)与Ep300依赖位点的重叠显示了许多TEXprog位点(图5E)。这进一步强调了ACLY和ACSS2分别以KAT2A和p300依赖的方式调节位点特异性组蛋白乙酰化,这与它们的物理相互作用和功能相互依赖性一致。
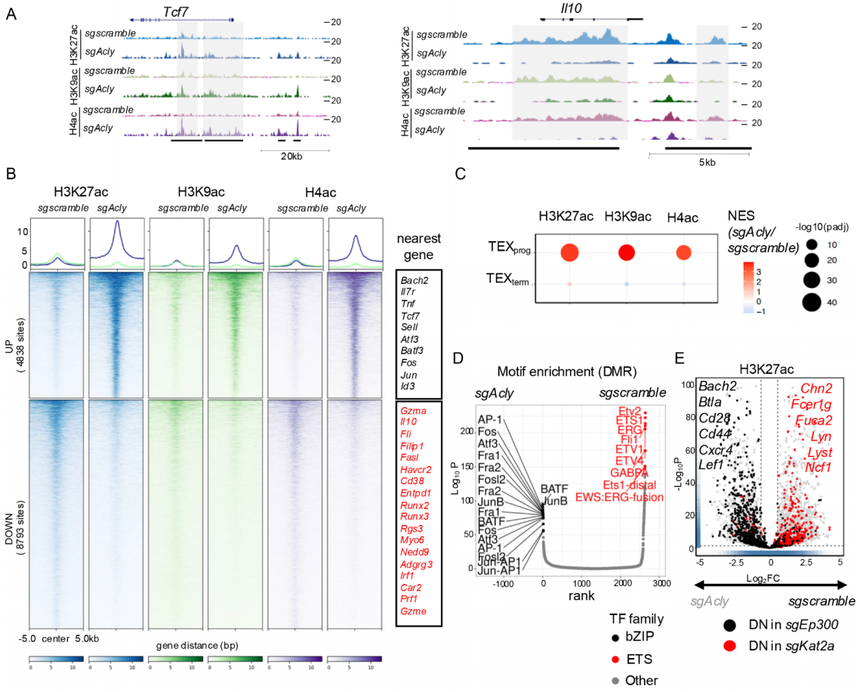
图5:ACSS2与ACLY分别协同p300和KAT2A,调控位点特异性的组蛋白乙酰化修饰。
8. 核内ACSS2促进TEXprog细胞分化
鉴于过表达ACSS2NLS能够促进LCMV-clone 13感染期间的组蛋白乙酰化和TEXprog分化,研究者推测这也可能对抗肿瘤免疫产生有益效果。为了验证这一点,研究在B16-GP33肿瘤植入后第10天将空载体对照或ACSS2NLS过表达的P14+T细胞过继转移到小鼠体内(图6A)。通过流式细胞术检测,在转移后第10天,ACSS2NLS过表达的肿瘤浸润淋巴细胞(TILs)显示全局H3K27ac和H3K9ac水平增加(图6B)。此外,对H3K27ac、H3K9ac和H4ac进行的CUT&Tag分析表明,ACSS2NLS过表达的肿瘤浸润淋巴细胞在TEXprog特征基因(如Tcf7和Bach2)处有特定的组蛋白乙酰化富集(图6,C和D)。而且,RNA-seq分析显示ACSS2NLS肿瘤浸润淋巴细胞中关键TEXprog相关基因(Id3、Egr2、Tcf7和Slamf6)表达增加,而关键TEXterm相关基因(Id2、Cish和Traf4)表达降低(图6E)。这些数据证明了核内ACSS2对TILs中TEXprog相关基因表达的影响。即把ACSS2强行送进细胞核(ACSS2^NLS过表达,简称OE)不仅能在慢性感染模型里促进TEXprog的形成,还能在肿瘤模型中改善肿瘤浸润淋巴细胞(TIL)的表观遗传状态和功能。
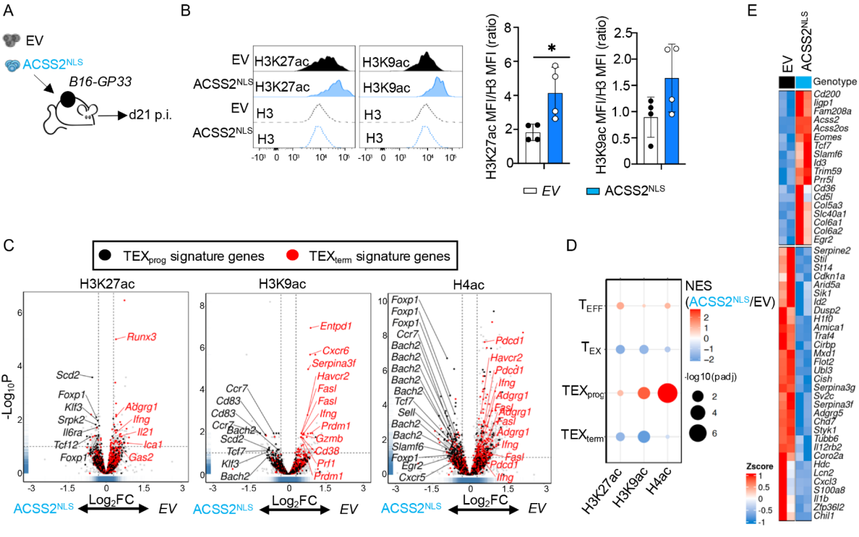
图6: 细胞核内ACSS2过表达促进TEXprog相关基因座组蛋白乙酰化并增强基因表达。
9. 核内ACSS2过表达和ACLY抑制与ICB协同增强抗肿瘤T细胞应答
研究测试了在肿瘤浸润淋巴细胞(TIL)中强制表达核内ACSS2是否能增强αPD-L1免疫检查点阻断(ICB)的治疗效果。结果显示,与空载体(EV)对照组相比,过表达ACSS2-NLS的TILs无论是在单独作用还是与ICB联用时,其祖细胞样耗竭性T细胞(TEXprog)的形成均得到增强(图7A),细胞因子产量也更高(图7B)。它们还会迁移至缺氧区域附近。因此,过表达ACSS2-NLS的TILs能有效控制肿瘤,并与ICB表现出强大的协同作用(图7C);而使用特异性抑制剂VY-3-135(49)抑制ACSS2则会削弱ICB介导的抗肿瘤免疫应答。
此外,鉴于ACSS2在Acly缺陷型CD8+T细胞中水平升高,研究推断直接抑制ACLY或许是另一种富集TEXprog细胞并提高ICB疗效的方法。的确,使用抑制剂BMS-303141抑制ACLY后,活化的CD8+T细胞中ACSS2的表达显著增强(图7D),并在体外耗竭培养中促进了TEXprog细胞的形成。同样地,在小鼠体内施用BMS-303141也轻微增加了TEXprog的形成,尽管在与ICB联用组中未观察到比单独使用ICB更显著的效果(图7E)。然而,BMS-303141与ICB的联合治疗极大地促进了TIL的累积,单独使用BMS-303141治疗也显示出类似趋势(图7F)。相应地,BMS-303141治疗能有效抑制肿瘤生长,并以一种依赖于CD8+T细胞的方式与ICB产生协同效应(图7G)。
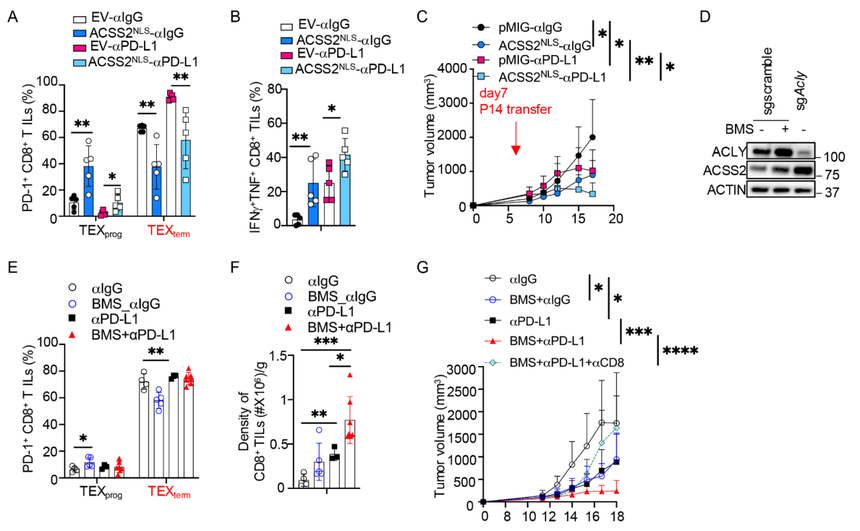
图7:核内ACSS2过表达或ACLY抑制可增强CD8+T细胞的抗肿瘤免疫功能
研究结论
该研究揭示了在癌症和慢性病毒感染中,营养代谢对CD8+T细胞耗竭(TEX)分化的影响机制。研究发现TEX细胞通过下调乙酰辅酶A合成酶2(ACSS2)而维持ATP柠檬酸裂解酶(ACLY)活性,从而将代谢从乙酸转向柠檬酸。这种代谢转换通过KAT2A-ACLY相互作用增加了柠檬酸依赖的组蛋白乙酰化,同时通过p300-ACSS2复合物降低了乙酸依赖的组蛋白乙酰化。过表达核定位的ACSS2或抑制ACLY可以防止TEX分化并增强肿瘤特异性T细胞反应。这些发现揭示了一个调控CD8+T细胞分化的营养介导的组蛋白密码,为基于代谢和表观遗传的T细胞治疗提供了新思路。
本文提到的相关技术,如有需求欢迎咨询👏~
{ 往 期 精 彩 回 顾 }
-
项目文章Adv sci(IF:14.1)|ATAC-seq+CUT&Tag表观多组学助力解析头颈部鳞状细胞癌的耐药性机制
-
化学TOP | 转录组测序助力客户解析枸杞高分支果胶多糖与机械屏障互作调节肠道免疫的分子机制
-
如何研究转录因子,合集文章让你的研究直接开挂
-
如何制备动物组织单细胞悬液,从经验积累到标准化操作全解析


)
)




)





)



)
